اسید و باز
کلمه «اسید» (به انگلیسی:acid) از واژه لاتین acidus به معنای «ترش مزه» آمدهاست. تعاریف گوناگونی برای اسید و باز وجود دارد، از جمله تعاریف آرنیوس، لوری-برونستد و لوییس.
تعریف قدیمی
اسیدها موادی ترش مزه اند خاصیت خورندگی دارند شناساگرها را تغییر رنگ میدهند و بازها را خنثی میکنند.بازها موادی با مزهٔ گس-تلخ اند حالتی لزج دارند شناساگرها را تغییر رنگ میدهند و اسیدها را خنثی میکنند.
لی بیگ: اسیدها موادی اند که در ساختار خود هیدروژن یا هیدروژن هایی دارند که در واکنش با فلزها توسط یون های فلز جایگزین میشوند.
آرنیوس: اسیدها موادی هستند که ضمن حل شدن در آب یون +H آزاد میکنند. بازها موادی هستند که ضمن حل شدن در آب یون -OH آزاد میکنند.این تعریف فقط به موادی محدود میشود که در آب قابل حل باشند. حدود سال ۱۸۰۰، شیمی دانان فرانسوی از جمله آنتوان لاووازیه، تصور میکرد که تمام اسیدها دارای اکسیژن هستند. شیمی دانان انگلیسی از جمله سر همفری دیوی، معتقد بود که تمام اسیدها دارای هیدروژن هستند. شیمی دان سوئدی، سوانت آرنیوس، از این عقیده برای گسترش تعریف اسید استفاده نمود.
لوری-برونستد: اسید گونهای است که در واکنش شیمیایی پروتون (یون+H)می دهد و باز گونهای است که در واکنش شیمیایی پروتون (یون+H)می پذیرد. لوری و برونستد این تعریف را بیان کردند، که از آن بر خلاف تعریف آرنیوس میتوان در محیط غیر آبی هم استفاده کرد.
لوییس: اسیدها موادی هستند که در واکنش های شیمیایی پیوند داتیو می پذیرند. بازها موادی هستند که در واکنش های شیمیایی پیوند داتیو میدهند.تعریف لوییس را با نظریه اوربیتال مولکولی هم میتوان بیان کرد. به طور کلی، اسید میتواند یک جفت الکترون از بالاترین اوربیتال خالی در پایین اوربیتال خالی خود دریافت کند. این نظر را گیلبرت ن. لوییس مطرح کرد. با وجود این که این تعریف گسترده ترین تعریف است، تعریف لوری-برونستد کاربرد بیشتری دارد. با استفاده از این تعریف میتوان میزان قدرت یک اسید را هم مشخص نمود. از این مفهوم در شیمی آلی هم استفاده میشود (مثلاً در کربوکسیلیک اسید).
نام گذاری
اسیدها بر اساس آنیون هایشان نام گذاری میشوند. پسوند یونی را حذف و با پسوندی جدید جایگزین میکنیم (گاهی اوقات پیشوند)، طبق جدول زیر. برای مثال، HCl دارای آنیون کلرید است، پس پسوند -ید نام را به صورت هیدروکلریک اسید درمی آورد.
خواص شیمیایی
در آب بین اسید (HA) و آب تعادل زیر برقرار میشود که آب به عنوان یک باز رفتار میکند:
قلیایی
محیطی که در دمای ۲۵ درجه سانتیگراد، pH آن بیشتر از ۷ باشد محیط قلیایی یا بازی نامیده میشود.قلیا عبارت است از ترکیبهای فلزهای قلیایی یا قلیایی خاکی که دارای گروه OH- هستند و محلول آنها میتواند چربی ها را در خود حل کند.
حالت
باز ها عموماً تلخ مزه هستند و حالت چرب مانند دارند و در واکنش خواهان گرفتن الکترون هستند باز ها با اسید واکنش نشان داده و تولید آب و نمک میکنند.
خصوصیات مشترک مواد قلیایی
تمام مواد قلیایی در برخورد با اسیدها از خود واکنش نشان میدهند؛همه آنها وقتی در آب حل میشوند به شکل یون هیدروکسید در میآیند.
چند ماده قلیای معروف
مایع سفید کننده
خون
آب دهان
صابون
آب دریا
آمونیاک
شما می توانید با تهیه برخی شناساگرهای ساده در خانه اسید یا باز بودن مواد را مشخص کنید. به عنوان مثال:
- کلم را خرد کرده به مدت حدود ۵ دقیقه در آب بجوشانید. سپس صبر کنید تا کاملاٌ سرد شده آن را از صافی عبور دهید. حال می توانید مواد گوناگون را از نظر اسید یا باز بودن مقایسه کنید. این شناساگر در محیط های اسیدی به رنگ قرمز و در محیط های بازی به رنگ سبز درمی آید.
می توانید به جای کلم از عصاره مواد دیگری همچون توت فرنگی، چغندر نیز استفاده کنید.
- نصف قاشق مربا خوری زردچوبه را با نصف فنجان الکل طبی مخلوط کنید. این معرف برای شناسایی بازها مناسب است. تغییر رنگ آن را در محیط اسید و باز مقایسه کنید.
- نکته: می توانید با قرار دادن کاغذ صافی در هریک از شناساگرهای فوق به مدت چند دقیقه و سپس خشک کردن آنها به جای محلول شناساگر، کاغذ شناساگر داشته باشید.
برخی مواد اسیدی در منزل: آبلیمو، سرکه، پرتقال برخی مواد بازی در منزل: مایع سفید کننده، عصاره پوست پرتقال
حال اسید یا باز بودن دیگر مواد را با کمک شناساگرهایی که ساختید مشخص کرده آنها را در یکی از این دو گروه قرار دهید.

قدرت اسیدها و بازها
در این مطلب می خواهیم بدانیم به طور کلی، قدرت اسیدها و بازها چگونه تعیین می شود و این موضوع چه تأثثیری در انجام واکنش ها و نتایج آن ها دارد.
خواص عمومی اسیدها:
- با فلزات واکنش می دهند.
- دارای pH پایینی هستند.
- زمانی که فنل فتالئین ( یک شاخص برای تعیین اسید و باز ) در حین تیتراسیون به محلول اسیدی اضافه می شود، محلول شفاف باقی می ماند.
*** تیتراسیون، فرایندی شیمیایی است که مقدار مشخصی از ماده ی اصلی نمونه ی حل شده با افزودن مقدار دقیق و مشخص از یک ماده ی حل شده ی دیگری معین می شود. محلول با غلظت معلوم به تدریج به محلولی که ناشناخته است، اضافه می شود( این کار با استفاده از یک بورت انجام می گیرد که یک لوله آزمایش دراز با دریچه ای در انتهای خود است ). این کار تا زمانی انجام می گیرد که به نقطه ی هم ارزی (نقطه ی پایان) برسد. مقدار ماده ی ناشناخته در این حالت می تواند محاسبه شود. نقطه ی هم ارزی با تغییر خاصی معین می شود. به عنوان مثال، از رنگ ماده ی شاخص مانند لیتموس یا خاصیت الکتریکی.
چه عاملی باعث ضعف یا قدرت اسیدها می شود؟
اسید قوی، اسیدی است که به آسانی تجزیه شود تا یون های هیدروژن تشکیل دهد. اسید ضعیف به راحتی نمی تواند تجزیه شود؛ بنابراین نمی تواند یون های هیدروژن را به راحتی تشکیل دهد.
پس عامل قدرت اسیدها تجزیه ی آسان و رها کردن یون هیدروژن است.
اسیدهایی مانند اسید استیک (HC2H3O2)، اسید هیدروفلوئوریک (HF)، اسید نیتروس ( اسیدی ناپایدار که فقط در محلول و به شکل نمک های نیترات شناسایی می شود( HNO2 ) جزو اسیدهای ضعیف هستند.
در شکل زیر تجزیه ی اسید استیک را مشاهده می کنید.
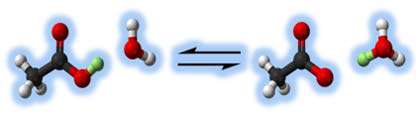
اسیدهایی مانند اسید هیدروکلریک (HCl)، اسید سولفوریک (H2SO4) و اسید نیتریک (HNO3) اسیدهایی قوی هستند.
خواص عمومی بازها:
- الکترولیت هستند.
- سطح pH آن ها بالاست.
- زمانی که فنل فتالئین در هنگام تیتراسیون به محلول بازی اضافه شود، رنگ محلول، صورتی خواهد شد.
چه عاملی باعث ضعف یا قدرت بازها می شود؟
همانند یک اسید قوی، باز قوی به راحتی تجزیه می شود و یون های هیدروکسید تشکیل می دهد نه هیدرونیوم. باز ضعیف نمی تواند یه راحتی تجزیه شود؛ بنابراین نمی تواند به آسانی یون های هیدروکسید تولید کند.
پس عامل قدرت بازها تجزیه ی آسان و رها کردن یون هیدروکسید است.
بازهایی مانند آمونیاک (NH3)، یون فسفات ( -PO4) و آب (H2O) ضعیف هستند.
بازهایی مانند هیدروکسید سدیم (NaOH)، هیدروکسید پتاسیم (KOH) و اکسید کلسیم (CaO) بازهایی قوی هستند.
در شکل زیر مثالی از انتقال پروتون را می بینید:
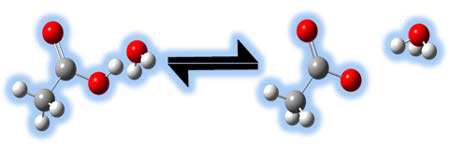
استفاده از مفهوم جفت های مزدوج اسید و باز به ما اجازه می دهد تا نظر خود را راجع به قدرت نسبی اسیدها و بازها به راحتی بیان کنیم.
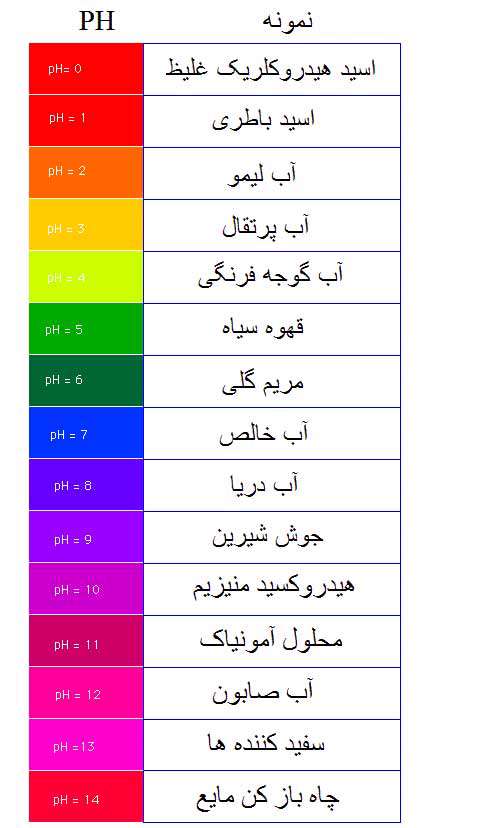
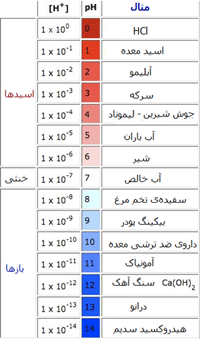
در جدول زیر غلظت یون هیدروژن و سطح pH را برای برخی مواد می بینیم:
اسید و باز
اسیدها موادی ترش مزهاند که خاصیت خورندگی دارند و شناساگرها را تغییر رنگ میدهند و بازها را خنثی میکنند. بازها موادی با مزه گس هستند که تلخ اند و حالتی مانند صابون در تماس با دست دارند، شناساگرها را تغییر رنگ میدهند و اسیدها را خنثی میکنند. همچنین اگر یک اسید و یک باز با هم واکنش بدهند تولید نمک و گاز هیدروژن می کنند.
اسید
در زیر به برخی از تعاریف قدیمی اسید پرداخته میشود.
لی بیگ:
اسیدها موادیاند که در ساختار خود هیدروژن یا هیدروژنهایی دارند که در واکنش با فلزها توسط یونهای فلز جایگزین میشوند.
 آرنیوس:
آرنیوس:
اسیدها موادی هستند که ضمن حل شدن در آب یون +H آزاد میکنند. بازها موادی هستند که ضمن حل شدن در آب یون -OH آزاد میکنند. این تعریف فقط به موادی محدود میشود که در آب قابل حل باشند. حدود سال 1800، شیمیدانان فرانسوی از جمله آنتوان لاوازیه، تصور میکردند که تمام اسیدها دارای اکسیژن هستند. شیمیدانان انگلیسی از جمله سر همفری دیوی، معتقد بود که تمام اسیدها دارای هیدروژن هستند. شیمیدان سوئدی، سوانت آرنیوس، از این عقیده برای گسترش تعریف اسید استفاده نمود.

لوری-برونستد:
اسید گونهای است که در واکنش شیمیایی پروتون (یون +H ) میدهد و باز گونهای است که در واکنش شیمیایی پروتون میپذیرد. لوری و برونستد این تعریف را بیان کردند، که از آن برخلاف تعریف آرنیوس میتوان در محیط غیر آبی هم استفاده کرد.

 لوییس:
لوییس:
اسیدها موادی هستند که در واکنشهای شیمیایی پیوند داتیو میپذیرند. بازها موادی هستند که در واکنشهای شیمیایی پیوند داتیو میدهند. تعریف لوییس را با نظریه اوربیتال مولکولی هم میتوان بیان کرد. به طور کلی، اسید میتواند یک جفت الکترون از بالاترین اوربیتال خالی در پایین اوربیتال خالی خود دریافت کند.
این نظر را گیلبرتن. لوییس مطرح کرد. با وجود این که این تعریف گستردهترین تعریف است، تعریف لوری-برونستد کاربرد بیشتری دارد. با استفاده از این تعریف میتوان میزان قدرت یک اسید را هم مشخص نمود. از این مفهوم در شیمی آلی هم استفاده میشود.
خواص عمومی اسیدها
- محلول آبی آنها یونهای پروتون آزاد میکند.
- موادی هستند که از نظر مزه ترشند.
- کاغذ تورنسل را سرخ رنگ میکنند.
- با برخی فلزات مانند آهن و روی ترکیب شده گاز هیدروژن میدهند.
- با قلیاها (بازها) واکنش نموده و املاح را تشکیل میدهند.
- با کربنات کلسیم (مثلاً به صورت سنگ مرمر) به شدت واکنش دارند، طوری که کف میکنند و گاز کربنیک آزاد مینمایند.
باز
باز در شیمی، رایجترین برداشت از مادهای محلول است که میتواند پروتونها را بپذیرد. از باز بیشتر به عنوان یک قلیا نام میبرند (تنها اگر یونهای -OH در آن باشد). این موضوع به نظریه برانستد-لوری در مورد اسیدها و بازها اشاره دارد. در تعریف دیگر، باز به هر ترکیب شیمیایی گفته میشود که وقتی در آب حل شد، به آن pH بیشتر از 7 بدهد. سدیم هیدروکسید و آمونیاک نمونههایی از بازهای ساده هستند. بازها شور مزهاند. از بازهها میتوان به عنوان شناساگر استفاده کرد و همچنین بازها با چربی واکنش میدهند.
شناساگرها
شناساگرها در محیطهای اسیدی یا بازی به رنگهای متفاوتی درمیآیند. از شناساگرها برای تعیین pH محلولها استفاده میشود.

از جمله شناساگرهای معروف میتوان به موارد زیر اشاره کرد:
- گلبرگ گل سرخ
- کاغذ تورنسل (لیتموس) که از درخت لیتموس به دست میآید.
- محلول فنول فتالئین (که اگر در یک محلول بازی ریخته شود به سرعت رنگ محلول را ارغوانی میکند).
- محلول متیل اورانژ (متیل نارنجی). پرش به: ناوبری، جستجو
اسیدها و بازها 
ثابت تفکیک اسیدی
اسید
واکنش اسید و باز
تیتراسیون اسید-باز
ثابت تفکیک
تابع اسیدی
محلول بافر
پیاچ
پروتونخواهی
خودیونش آب
قدرت اسیدیانواع اسید برونستد · لوویس · معدنی
آلی · قوی
ابراسیدها · ضعیفانواع باز برونستد · لوییس · آلی
قوی · ابربازها
غیرنوکلئوفیلی · ضعیف
با سلام جهت استفاده از مطالب صلوات بر محمد و آل محمد بفرستيد و لطفاً لينك ما را در وبلاگ يا وبسايت خود قرار دهيد و به دوستان خود معرفي نماييد باتشكر - مديريت وبلاگ

نظرات شما عزیزان:
.: Weblog Themes By Pichak :.




 آمار
وب سایت:
آمار
وب سایت:

